REDUCE-IT(EPAの心血管イベント抑制の検討)を読む。 2018年最後の居酒屋抄読会より
<はじめに>
EPAの心血管イベント抑制効果を検討した研究は数多くありますが、「心血管イベントを抑制できた」という試験はほとんどなく、個人的には「EPAに心血管イベントの抑制効果はない」と考えていました。
最新のコクランレビューを見ても、「little or no effect of increasing LCn3 on all-cause mortality (RR 0.98, 95% CI 0.90 to 1.03, 92,653 participants; 8189 deaths in 39 trials, high-quality evidence), cardiovascular mortality (RR 0.95, 95% CI 0.87 to 1.03, 67,772 participants; 4544 CVD deaths in 25 RCTs), cardiovascular events (RR 0.99, 95% CI 0.94 to 1.04, 90,378 participants; 14,737 people experienced events in 38 trials, high-quality evidence), coronary heart disease (CHD) mortality (RR 0.93, 95% CI 0.79 to 1.09, 73,491 participants; 1596 CHD deaths in 21 RCTs), stroke (RR 1.06, 95% CI 0.96 to 1.16, 89,358 participants; 1822 strokes in 28 trials) or arrhythmia (RR 0.97, 95% CI 0.90 to 1.05, 53,796 participants; 3788 people experienced arrhythmia in 28 RCTs).」と一言でまとめると「EPA、DHAの心血管予防効果は無いかあっても小さい」とされています。
PMID: 30521670
そんなEPA逆風の中、「高用量EPAで心血管イベントが抑制された」という研究が出てきており、居酒屋抄読会参加メンバーの希望とも重なったので、2018年の締めくくりとして読んでみることにしました。
<お題論文など>
・お題論文
Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia. - PubMed - NCBI
PMID: 30415628(一時全文フリーだったが、今では見れなくなっている)
・登録情報
・プロトコル論文
PMID: 28294373(全文フリー)
上記プロトコル論文にこれまでの流れが簡単に載っているので、参考までにどうぞ
・居酒屋抄読会の案内と録音
録音は以下のリンクよりどうぞ
<批判的吟味>
ここから、本文を読んでいきたいと思います。
①RQ
・P:45歳以上で心血管イベントの既往歴がある。
もしくは、50歳以上で糖尿病があり、心血管イベントハイリスクである者
空腹時トリグリセライド(TG)150~499mg/dL ※抄録では135~499mg/dLになっている
スタチン治療でLDL41~100mg/dLで4週以上安定している
※参加国:オーストラリア、カナダ、インド、オランダ、ニュージーランド、ポーランド、ルーマニア、ロシア、南アフリカ、ウクライナ、アメリカ合衆国
※スポンサーのAmarin社はアイルランドに本社を置くEPA製剤(Vascepa®)のみを販売する会社
https://www.amarincorp.com/about_us.html
Vascepa®専用ページ
・I:EPA1回2g、1日2回(Vascepa®)
・O:複合心血管イベント(心血管死、非致死性心筋梗塞、非致死性脳卒中、
冠動脈再建術、不安定狭心症)
複合(心血管死、非致死性心筋梗塞)
心筋梗塞(致死性、非致死性双方を含む)
総死亡 など
・T:観察期間の中央値4.9年
⇒実際に集まったのは、年齢64歳、女性29%、白人90%、BMI30.8、CVD二次予防70.7%、エゼチミブ服用6.4%、スタチン強度(弱6.4%、中62%、強30%)、糖尿病(1型0.7%、2型58%、なし41.5%)、高感度CRP2.2、TG216.5、HDL40、LDL74、血中EPA濃度26.1μg/mL
※LDLのみ両群に有意差があったと本文中に記載あり
※糖尿病に関する各情報(罹病期間、コントロール状況、服用薬剤)、喫煙状態、高血圧に関する情報(血圧、服用薬剤)、腎機能など組み入れ基準には記載があるのに、試験に組み込まれた患者背景としては提示されていないため、両群が同等であったかは不明
(正しくランダム化されていれば、記載されていない患者背景も均等になっているはずなので、絶対的にダメというわけではないが、結果に影響する因子なので記載してほしかった)
②方法論
・ランダム化:層別ランダム法(一次予防30%、二次予防70%、エゼチミブ服用、地域で層別化)。
・盲検化:3者(患者、研究者、アウトカム評価者)
※データの管理解析はスポンサー(非盲検)が担当
・解析:ITT
・介入以外の処置:脂質代謝に影響する薬剤、サプリメントは禁止。
LDLを緊急で下げる(130mg/dL以上)場合はスタチン増量もしくはエゼチミブ追加は許可
※脂質以外の薬剤、コントロール目標についてはプロトコル上に記載なし
・サンプルサイズ:7990名。(1612イベント)
・追跡率:I群93.6%、C群92.9%
③結果
・プライマリ I群:17.2%、C群22.0% HR0.75 95%CI:0.68~0.83 NNT21
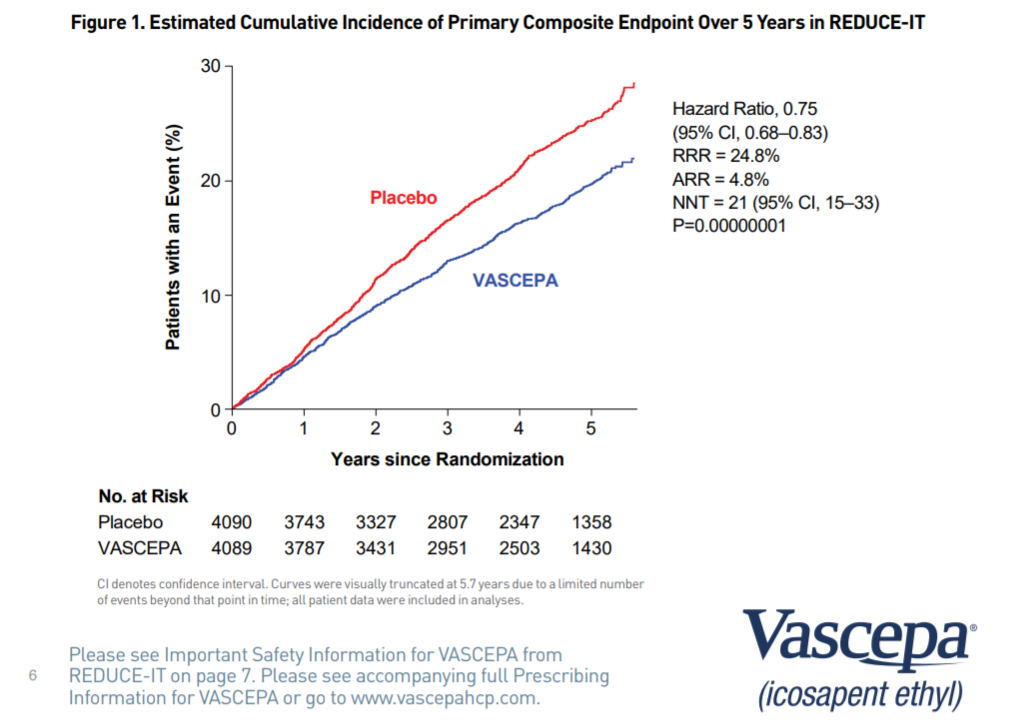
https://investor.amarincorp.com/static-files/7eed9f2b-3f7a-493f-9113-99d981a198b1より
・3P-MACE I群:11.2%、C群14.8% HR0.74 95%CI:0.65~0.83 NNT28
・心不全入院 I群:3.4%、C群3.5% HR0.97 95%CI:0.77~1.22
・心血管死 I群:4.3%、C群5.2% HR0.80 95%CI:0.66~0.98
・狭心症入院 I群:2.6%、C群3.8% HR0.68 95%CI:0.53~0.87
・総死亡 I群:6.7%、C群7.6% HR0.87 95%CI:0.74~1.02
・TG I群:-18.3%、C群+2.2%
・LDL I群:+3.1%、C群+10.2%
・EPA濃度 I群:+112.6μg/mL、C群-2.9μg/mL
有意差のついた主な有害事象(I群 vs C群)
・下痢:9.0% vs 11.0%
・末梢性浮腫:6.5% vs 5.0%
・便秘:5.4% vs 3.6%
・心房細動:5.3% vs 3.9%
・貧血:4.7% vs 5.8%
<まとめ>
すさまじい結果。
これまでの一連の試験結果と大きく食い違うため「ディオバン事件」を彷彿とさせるが、試験デザインはしっかりしておりディオバン事件で見られた試験デザイン上の問題は見受けられない。
しかも、TGまで明らかに改善している。(通常EPAではここまで明らかなTG低下効果は見られない)
※JELIS試験(日本人対象のEPA製剤の試験)でも有意差をつけてEPAが良かったというご指摘があるかと思うが、JELISでプライマリエンドポイントに差をもたらしたのは「入院」であり、PROBE法を用いているため現場レベルで調整できるエンドポイントをもって有意差をつけた点は注意が必要。「入院」を除いた心血管エンドポイントでは有意差はなかった。
1日4gという高用量EPAの効果だろうか?(日本のEPAの承認量は1.8g、最大でも2.7g)ただ、EPA濃度で見るとJELIS試験では90μg/mL超という点は注目したい(日常生活におけるEPAの摂取量は日本が欧米の8倍程度あるらしい)
ただ、患者背景・試験期間中・試験終了時の心血管リスクの管理状態が非開示なのが気になる。
本社のあるアイルランドが参加国に入っていないのは、ベースラインのEPA濃度が高い海洋国だからだろうか?
Amarin社が計画しているもう一つの結果がどうなるか今から楽しみではある。
PMID: 29365351
CARMELINA試験(リナグリプチンの心血管系への影響をプラセボと比較する非劣性試験)を読んでみた
<はじめに>
DPP4阻害薬の心血管イベントを検討した研究で話題の最新論文を読んでみました。
7/26付けの速報で「心血管イベント抑制」ではなく「主要評価項目達成」だったので、他のDPP4阻害薬と似たような結果だったんだろうなとは思っていましたが、先日ダパグリフロジンについて取り上げたので、ついでに読んでみました。

<お題論文など>
・お題論文
PMID: 30418475(全文フリー)
・登録情報
・プロトコル論文(今回も読んでないけど)
PMID: 29540217(全文フリー)
<批判的吟味>
ここから、本文を読んでいきたいと思います。
①RQ
・P:18歳以上(日本のみ20歳以上)の2型糖尿患者。HbA1C6.5%~10.0%。
BMI≦45 kg / m2。
以下の①か②を満たすこと
①アルブミン尿症(微小またはマクロ)および大血管疾患(虚血性心疾患、脳血管疾患、PAD)の既往
②腎障害:eGFR 15 以上45 mL/min/1.73 m2未満かeGFR 45 以上 75 mL/min/1.73 m2 でUACR > 200 mg/g か > 200 μg albumin/min か > 200 mg albumin/24 h を満たすもの
前治療(DPP4阻害薬、GLP1アゴニスト、SGLT2阻害薬を除く)でランダム化前8週間安定 。(インスリンの投与量は投与量の変化が10%以内のもの)
・I:リナグリプチン5mg1日1回
・C:プラセボ1日1回
※元のプライマリアウトカムは4P-MACE(=3P-MACE+不安定狭心症による入院)だったが、他の試験とそろえるため2016年(登録情報は2017.6)にセカンダリアウトカムだった3P-MACEが昇格
<セカンダリ>腎アウトカム(eGFR40%減、末期腎不全、腎死)
<2017.6に削除されたセカンダリ>3P-MACE、腎アウトカム(eGFR50%減、末期腎不全、腎死)
・T:観察期間の中央値2.2年(元は4年、アウトカム変更に伴い4.5年へ変更。611イベントの発生が必要と見積もられている)
⇒実際に集まったのは、年齢66歳前後、女性35%、白人80%弱、ヨーロッパ40%強、eGFR 54.7mL/min/1.73 m2、UACR162mg/g、BMI31.4、平均罹病期間14.5年、HbA1C8%、非喫煙者53%、収縮期血圧140mmHg、 拡張期血圧78mmHg、虚血性心疾患の既往58%、メトホルミン服用54%、SU剤32%、インスリン57%強、ACEiかARB80%強、スタチン服用71%
※両群に目立った偏りはなさそう
②方法論

・ランダム化:ブロックランダム法(地域で層別化)。
・盲検化:2者(患者、研究者)
・解析:FAS
・介入以外の処置:DPP4阻害薬、GLP1アゴニスト、SGLT2阻害薬は禁止。
※プロトコル36ページに「Sulphonylureas and insulin are known to cause hypoglycaemia. Therefore, caution is advised when linagliptin is used in combination with a sulphonylurea and/or insulin. A dose reduction of the sulphonylurea or insulin may be considered.」とあるが、どうやってI群に減量の考慮を伝えたのだろう?
※HbA1CはI群で最初の一年およそ0.5%下がったが、以降その差は小さくなっている。
・サンプルサイズ:3P-MACEで計算。611イベントとある。
腎アウトカムも計算されていて432イベント。
イベント数は854件と計算上充分であった。
③結果
・MACE:I群12.4%、C群12.1% HR1.02 95%CI 0.89~1.17
非劣性マージン1.3なので非劣性
・腎複合:I群9.4%、C群8.8% HR1.04 95%CI 0.89~1.22
・SAE:I群37.0%、C群38.5%
・重症低血糖:I群3.0%、C群3.1%
・類天疱瘡:I群7件、C群0件
・皮膚病変:I群5件、C群1件
<まとめ>
プロトコルに「インスリン使用者とSU剤使用者にリナグリプチン服用時に減量考慮する旨の勧告」とあったのだが(誤訳してるかも)、どうやって盲検化維持したのだろう?
不安定狭心症による入院はI群1.2%、C群1.4%、心不全により入院がI群6.0%、C群6.5%と差はないので、上記勧告による影響は小さいのだろうが。
DECLARE–TIMI 58 (ダパグリフロジンの心血管系への影響をプラセボと比較する非劣性試験)を読んでみた
<はじめに>
SGLT2阻害薬の心血管イベントを検討した研究で話題の最新論文を読んでみました。
メーカーからの速報ではイイ感じだと聞いていたのですが、蓋を開けてみたらエンパグリフロジン、カナグリフロジンと違い悲しい結果に(´;ω;`)
これまでの研究で示された心血管イベント抑制はSGLT2阻害薬のクラスエフェクトだと思っていたので、「どうしてこうなった?」を探るべく、本文を読んでみました。
アストラゼネカのフォシーガが2型糖尿病患者さんを対象とした大規模心血管アウトカム第III相DECLARE-TIMI58試験において良好な結果を達成

<お題論文など>
・お題論文
Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. - PubMed - NCBI
PMID: 30415602(全文フリー)
・登録情報
DECLARE-TIMI58 臨床試験概要詳細画面|一般財団法人日本医薬情報センター 臨床試験情報(日本語)
※上記二つとも組み入れ基準がざっくりとしか書いておらず、P(被験者)情報を取得するには役に立たないので注意
・プロトコル論文(今回読んでないけど)
PMID: 29898853
<批判的吟味>
ここから、本文を読んでいきたいと思います。
①RQ
・P:40歳以上の2型糖尿患者。HbA1C6.5%~12.0%。
CCr≧60mL/min。
心血管リスク因子(男性55歳以上、女性60歳以上、高血圧、脂質異常症、現在の喫煙)複数保有かアテローム性心疾患(虚血性心疾患、脳血管疾患、PAD)の既往
WOCBP(妊娠の回避くらいの理解しかしてないです)
・I:ダパグリフロジン10mg1日1回
(国内承認量は1日1回5mg、効果不十分時10mgへ増量)
・C:プラセボ1日1回
・O:<安全性>3P-MACE(心血管死、心筋梗塞、脳卒中)
<有効性>3P-MACE、心血管死+心不全による入院の複合アウトカム
(アウトカムのうち複合の方は2016.12にEMPA-REGでいい結果が出たことによりセカンダリより昇格したことが本文METHODSに記載されている)
<セカンダリ>腎複合アウトカム(eGFR40%減、末期腎不全、心血管死、腎死)、全死亡
<2016.12に削除されたセカンダリ>不安定狭心症、再灌流術、体重の変化
・T:観察期間の中央値4.2年(元は3年、MACE1390件発生まで追跡の予定)
⇒実際に集まったのは、年齢64歳前後、女性37~38%、白人80%弱、北米30%強、BMI32、平均罹病期間10~11年、HbA1C8.3%、収縮期血圧135mmHg、拡張期血圧58mmHg、アテローム性心疾患の既往40%、メトホルミン服用80%強、ACEiかARB80%強、スタチンもしくはエゼチミブ服用75%
※両群に目立った偏りはないが、変化を調査している体重については記載がない。
②方法論
・ランダム化(プロトコルより):ブロックランダム法(CVリスク、血尿の有無で層別化)。中央(アストラゼネカ社)割り付け。病態、参加地域、性別が一定の比率になるようモニターしながら募集した。
・盲検化:4者(患者、研究者、調査者、アウトカム評価者)
・解析:有効性はITT(I群8582名、C群8578名。割り付け全員が解析された)
安全性はFAS(I群8574名、C群8569名)
・介入以外の処置:チアゾリジン系とSGLT2阻害薬は禁止。
※:ADA、EASDに従いHbA1C<7.0%を目標とするが、治療に使用した薬剤については非公開とするとプロトコル40ページにあり、詳細不明。
※2:被験薬以外のSGLT2阻害薬服用率が本文中に公開されており、I群3.4%、C群6.1%とある。
・サンプルサイズ:MACEで計算。17150人、1390イベントとある。
参加人数は満たしたが、イベント数は913件と未達であった。
③結果
・MACE:I群8.8%、C群9.4% HR0.93 95%CI 0.84~1.03
非劣性マージン1.3なので非劣性
・心血管死+入院:I群4.9%、C群5.8% HR0.83 95%CI 0.73~0.95
・入院:I群2.5%、C群3.3% HR0.73 95%CI 0.61~0.88
・心血管死:I群2.9%、C群2.9% HR0.98 95%CI 0.82~1.17
・腎複合:I群4.3%、C群5.6% HR0.76 95%CI 0.67~0.87
・全死亡:I群6.2%、C群6.6% HR0.93 95%CI 0.82~1.04
・本文中では「リスクファクターに良い結果を与えた」とあったリスクファクター達

・SAE:I群34.1%、C群36.2% HR0.91 95%CI 0.87~0.96
→不安定狭心症:I群2.8%、C群2.8%
→急性心筋梗塞:I群2.7%、C群2.3%
・低血糖:I群0.7%、C群1.0% HR0.68 95%CI 0.49~0.95
・ケトアシドーシス:I群0.3%、C群0.1% HR2.18 95%CI 1.10~4.30
※「ケトアシドーシスを起こした人の80%が組み入れ以前にインスリンを使っていた」と本文にある。結果は示されていないが両群で脱水は同等だったとも記載あり。
・切断:I群1.4%、C群1.3% HR1.09 95%CI 0.84~1.40
・性器感染症:I群0.9%、C群0.1% HR8.36 95%CI 4.19~16.68
<まとめ>
これまでのSGLT2阻害薬の結果に比べると思わしくない結果だった。
試験期間を延長したが、目標イベント数が達成できず、検出力が不足したのではないか?と思う。
一方で、少ないながらも性器感染症など以前から言われている有害事象はしっかり有意差をつけて増加しており、今後も注意を要すると思われる。
ディスカッションにも書いてあったが、レジメン違反が多かったと。しかし、両群で行われた詳細な治療内容は非公開であり、その違反が結果に与えた影響を推し量ることは難しい。(思わしくない結果への言い訳感が強く、読むのが苦痛だったので読み飛ばしたかもしれないが)
個人的な感想だがTIMI研究会(TIMI Study Group - CLINICAL TRIALS)が絡むと思わしくない結果が出やすい気がする。
11/11開催、第17回studentCASP 神戸薬科大学の予習をしてみた(不参加組より)
明日11/11に神戸薬科大学で開催されるCASPの予習を参加もしないのに勝手に予習して垂れ流すという頭の悪い企画です。
(博多駅そばのネカフェから投稿しているという)
今夜19時以降に居酒屋抄読会in中州やります(https://twitcasting.tv/zuratomo4)ので、ご視聴お願いします!
(超重要項目なので赤字にしたった)
【お題論文】
PMID: 28209290
【批判的吟味】
http://spell.umin.jp/EBM_materials_BTS.html
はじめてレビューシートにそって書いていきます
①PICO
P:リウマチ性疾患(関節リウマチ、強直性脊椎炎)の患者
I:バイオシミラー(インフリキシマブ、アダリムマブ、エタネルセプト)
C:参照薬剤(要は先発品)
O:反応率(ACR20とACR70)、有害事象
②コクラン?→いいえ
③GRADE?→いいえ
④網羅的に集めた?
・データベース:MEDLINE、Google Scholar、Scopus、EMBASE、CENTRAL
・検索語と期間省略
・対象研究:RCT
・参考文献:記載なし
・専門家への連絡:なし(データが足りないとき個々の研究者にコンタクトはした)
・非出版:調べていない
・言語制限:なし
⑤集まった?
研究数9(Fig1の8は健康ボランティアのため除外)でファンネルプロットしているが、特にする必要はなかったかも
⑥研究の質の評価
・二者以上独立?:3人が独立してやっている
・合意形成:話し合い(第三者の調停なし)
・Cochrane risk of bias tool、Jadad scoreで評価したとあるが本文中に結果が示されているのはJadad scoreのみ(全部3以上だった)
⑦結果(RR、95%CI)
・ACR20
インフリキシマブーRA-12~16週:1.04(0.96~1.13)
24~30週:1.02(0.91~1.15)
48~54週:1.12(0.98~1.29)
インフリキシマブーAS、アダリムマブ、エタネルセプトは研究数1のため省略
・ACR70
インフリキシマブーRA-12~14週:1.16(0.81~1.64)
24~30週:1.01(0.80~1.29)
48~54週:2.16(0.51~9.12)
エタネルセプトーRA-24~30週:1.10(0.86~1.39)
・有害事象(全体):0.98(0.91~1.07)
・有害事象(上気道感染):1.54(1.01~2.37)バイオシミラーで多かった。
【まとめ】
同等性が求められるだけに、大体同じ(一部有意差ついた)結果。
ただ、これSR&MAしてまでまとめる意味あったのかな?という感想しかでてこなかったです。
明日の神戸薬科大学CASPの盛会&成功を祈念しています。
「立てよ薬剤師」第二弾:薬剤師が情報発信をする意味?
なんか与えられたお題をそのままタイトルにしてしまう知恵のなさ。
答えは単純で「言葉にしなきゃ伝わるもんも伝わらねぇから」以外にないでしょ?
しかも、相性があるので、僕の言葉は届かないのに、あなたの言葉なら届くってやつがあるんですよ。
だからこそ多くの薬剤師が情報発信することにこそ意味があると思うんですけどね。
あ、デマはダメっすよ(;^ω^)
いや、弊社には「あ?」と「は?」だけでコミュニケートできてしまうモンスタースタッフ(♀)(外見も含む)がいますが。
(;^ω^)<ホラー映画の女形モンスターがすべて可愛く見える(実話)
(;^ω^)<初めて正面顔を見たとき、悲鳴を上げそうになった(実話)
はい、今回は「立てよ薬剤師」プロジェクト第二弾です。
参考:前回はこんな感じ
るるーしゅ先生の記事がリンク切れしてる(;^ω^)
ひねりを入れられるほどのお笑いのセンスがない(生まれも育ちも関西)ので、与えられたテーマのままに書き連ねたいと思います。
あ、結論は冒頭に書いたので、興味ない人はここでブラウザそっ閉じですよ。
①そもそもブログ書いて何になるの?アフィもないのに?
話のネタにはなります。チェックシートとか貼っておけば、他人に説明するときの資料集にもなりますしね。
例えば、ネットワークメタ解析のチェックシートは、知り合いの先生が「院内抄読会でランセットのネットワークメタ解析の論文を読みたいがどう読めばいいか自信がない」とのことで、大事な点を漏らさず説明しやすくする目的で作成しました。
先生、晩御飯ごちそうさまでした。(先生が見ていた時用のコメント)
なお、資料集のアイデアは南郷先生のパクリです。
http://spell.umin.jp/EBM_materials.htm
②どんな目的でブログ書いてるの?
特にないです。(;^ω^)
いや、ツイッタランドでの圧力に屈しました。(笑)
当初は目的も運営方針もなく書いていましたが、「EBM初心者を対象にしたブログはあるのに、それ以降の人に分かり易く浸透しているブログがないので、こんなニッチな層なら競合せんやろ」と思って書いてます。
アフィもないので、小遣い稼ぎにもならないから、自由気ままにやってます。(だから記事を読んでほしい対象が1人とかいう馬鹿記事も書けます)
対象1名の記事の例(この例はけいしゅけ先生:https://keisyuke-blogyakkyoku.xyz/)
③臨床とのつながり
やっぱり、特にない(;^ω^)
いや、提案時はそちらを読んでるし、仕事中にこのブログを見ることはないっす!(職場バレはいやぁぁぁぁぁっ!)
僕の夢が「居酒屋抄読会で日本各地を回り、全国のEBMerと地の旨いものを食い、旨い酒を酌み交わしたい」なので、その一助にはなっているかと思いたい。(願望)
ここで、居酒屋抄読会in北海道後の酔っ払いの戯言をば。


誰かと繋がりたいなら、その意思を表明しないとってことですね。
あ、わたくし居酒屋抄読会の参加者の他に、結婚相手(女性)も募集しておりますので、よろしくお願いいたします。
バロキサビルマルボキシル(ゾフルーザ)の第三相臨床試験(CAPSTONE 1)を読んでみた
<はじめに>
「ゾフルーザの論文がNEJMにでた」と聞いて、「ハイリスク者対象のCAPSTONE 2が出たのか~」と喜び勇んで検索してみたら、「CAPSTONE 1やん!審査資料で大体読んだからいらんわ」となったのですが、せっかくなので読んでみます
<お題論文などなど>
Baloxavir Marboxil for Uncomplicated Influenza in Adults and Adolescents. - PubMed - NCBI
PMID: 30184455
ゾフルーザ審査概要(臨床概要3に目的の情報があります)
審査報告書(2018年02月23日)の2と3
http://www.pmda.go.jp/drugs/2018/P20180312001/340018000_23000AMX00434000_A101_1.pdf
http://www.pmda.go.jp/drugs/2018/P20180312001/340018000_23000AMX00434000_A102_1.pdf
<審査資料について>
審査資料(概要、報告書)はPMDA における審査の概要と過程が記載された文書のこと。(一般に公開されている)
審査報告書・申請資料概要 | 独立行政法人 医薬品医療機器総合機構
病院薬剤師業務への審査報告書の利活用について(https://www.jshp.or.jp/banner/guideline/20151214.pdf)
個人的には、採用の可能性のある新薬については、治験の概要一覧と有効性・安全性のデータに目を通すようにしている。(少なくとも院内勉強会の前には)
以下は参考(良かったら読んでみてください)
<いつも通り論文を読んでみる>
・リサーチクエスチョンは
P:12~64歳(2016~2017seasonで)、38度以上の発熱、全身症状が1つ以上、呼吸器症状が1つ以上、症状が出てから48時間以内、外来患者
I:バロキサビル(体重80kg未満は40mg、体重80kg以上は80mg)
C1:プラセボ
C2:オセルタミビル(タミフル) 75mg 1日2回5日間
(この群への組み入れは20~64歳。この試験実施時10代への投与は禁忌)
人数比はI:C1:C2=2:1:2
O:インフルエンザ症状(咳、咽頭痛、頭痛、鼻づまり、発熱または悪寒、筋肉または関節痛、および疲労)緩和までの時間 (9/21追記、1~14日まで測定)
・ランダム化→されている(感染確定例で示されている)
Table1(12~64歳、プラセボ用)とTableS2(20~64歳、オセルタミビル用)
※タミフル群はバロキサビル群より喫煙者が多く、組み入れが遅め、ワクチン接種者多めで、ワクチンを除くとタミフルが不利な割り付けになっているように感じた
・盲検化→ 二重(参加者、研究者のみのよう)
・ITT?→ITTI(インフルエンザ感染が確定+一回は治験薬を受け取った)
・施行バイアス→各群で影響を与えそうな薬剤等は制限されている
・サンプルサイズ→1494名
・結果(インフルエンザ症状緩和までの時間)
Fig2より、ゾフルーザ53.7時間vsプラセボ80.2時間 差26.5時間(95%CI:17.8~35.8)
FigS4より、ゾフルーザ53.5時間vsタミフル53.8時間 差0.3時間(95%CIの記載なし)
<審査資料と比較してみる>
・試験の概要

・P(対象患者)の情報を見てみる
※CAPSTONE1は審査資料では「T0831試験」と呼称されている

・アウトカムとその定義


・結果

※論文では出ていなかったタミフル群との差の95%CIが-6.6~6.6であることが分かる
なぜ、論文では記載を省略したのだろう?
以下は論文でも出ていたカプランマイヤー曲線(vsプラセボ)

以下は、論文で省略された図

なぜか白黒(-_-;)、タミフルとゾフルーザで重なりすぎて区別がつかない(;^ω^)
ここからはサブ解析など
先ずはインフルエンザの型別の効果

ちょ、B型でゾフルーザ飲んだ方が回復遅れてるやん(タミフルも)(;^ω^)
n数が少ないので、スモールサイズエフェクト(極端な結果が出やすい)ではないかと思うのですが
(実際、第二相ではインフルエンザの型によらず罹病期間短縮効果が見られている)
※審査でも同様の説明で「A型のみ」という限定がつかなかった模様
で、お次は人種
と、いってもCAPSTONE1試験は日本とアメリカでしか実施されていない。
(計画にはカナダ、韓国、タイ、シンガポールがあったようだが、なぜ実施国から外れたのかは不明)(9/21追記、審査資料ではカナダのみなぜか言及されている)

ちょ、白人とアジア人で罹病期間の中央値が倍近く違うんですけど(;^ω^)
でも、短縮時間は一緒くらいなのね
で、ウイルス力価(ここだけゾフルーザがタミフルに勝った)

いうほどの差に見えない(;^ω^)
治験中に見られたゾフルーザ耐性株でのウイルス力価

6日目に二度目のピークが出ていると、、、
で、臨床症状はというと

耐性の有無で有症状期間が変わらなかったと
ウイルス力価と臨床症状は必ずしもリンクしないと
(していたらゾフルーザはタミフルより症状緩和が速いはず)
<まとめ>
論文では審査資料に比べ省略されている情報が散見されたが、評価するうえで大勢に影響はなさそう。
安心して「ゾフルーザの効果はタミフルのそれを超えるものではない(優れているかわからない)」と言えそうです。
で、個人的に引っかかったのは「陽性対照扱いのタミフル群の被験者割り付け数が多い」という点です。ただの陽性対照なら「2:2:1」に割り付けたとき「1」になるのが自然なので。
論文、臨床試験登録情報、審査資料にも直接の言及がないのですが、ここまでの人数を割り付けている場合、本来この試験は「タミフルに対する優越性」を検定する目的があったのではないか?と。
結果から言うと「タミフルとの優越性を検討しようとしていたが、論文や審査資料でその点に触れていない」が答えです。
この場合プロトコルを見るのが良いのですが、全文フリーでもない論文のプロトコルを読むのは困難です。もしプロトコルが見れたとしてもページ数も多く読むための心理的・時間的・体力的ハードルは高そうです。
ここで「ゾフルーザ」が優先審査になるくらいの塩野義製薬にとって目玉商品であったことを思い出してください。
これほどの期待の商品を株主にアピールしないわけがないと。
早速、塩野義製薬のホームページから「株主・投資家の皆様へ」をクリック。IR資料を見てみましょう。
IR資料室 | 株主・投資家の皆さま | シオノギ製薬(塩野義製薬)
アピールなのですから、プレゼンテーション資料を見てみましょう。
プレゼンテーション資料 | IR資料室 | 株主・投資家の皆さま | シオノギ製薬(塩野義製薬)
ゾフルーザの結果速報がありますが無視して、開発時期と重なる第1四半期Conference Call (2017年7月31日)を見てみます。
http://www.shionogi.co.jp/ir/pdf/p170731.pdf
ページをスクロールするとS-033188(ゾフルーザの開発コード)のページが見つかります。

はい、タミフルとの優越性が「主な副次目的」に記載されています。
ここでお伝えしたかったのは、前々回から書いていた臨床試験登録情報の弱点です。
「登録情報の登録前にされた変更や登録から外された情報は追えない」ということです。
今回のは「対プラセボ」をどこにも明記していなかったので、タミフルに優越性が示されればそちらがプライマリアウトカムになっていたのかもしれません。
<おまけ>
開発中の新薬にどんなものがあるか知りたくなることはありませんか?
僕は最初に勤めた職場で「○○の新薬はいつごろ市販されそうか?」という問い合わせを時々受けていました。
そんな時最初に調べるのが、日本製薬工業協会のホームページです。
ただ、メーカーによっては更新が遅く使い物にならないので、そういう時に株主用の資料を見ていました。
開発予定の新薬=そのメーカーの成長の期待になるので。
今回はここまで。
最後までお付き合いいただきまして、ありがとうございます。
<追記>
耐性の有無による有症状期間について以下のようなご指摘を受けました。

論文を確認したところ、ご指摘の通りでした。
ご指摘ありがとうございます。
で、審査資料の方ですが、貼り付けた表40を確認すると耐性の有無で63.1時間vs52.4時間となっていました。
審査過程では、63.1時間vs52.4時間で検討して「このアミノ酸変異(耐性化)が臨床症状に影響を与える可能性は低い」としたようです。
この資料と論文の食い違いに関してはメーカーに聞いてみたいところですが、そもそも塩野義製薬のMRさん見たことない職場なので、卸さん経由で聞いてみたいと思います。
<2019/1/4追記>
耐性の有無による有症状期間の審査資料とNEJM(論文)との食い違いの件。
メーカーに問い合わせたところ、NEJMはシーケンスがかけられた人だけ(著効例を除いた)審査資料は投与後すぐにウイルスが検出できなくなった例も見なしで解析したとのことでした。
また、学術の方に現場への情報伝達はどちらの時間で行っているか聞いたところ、「審査資料に基づいて行っている」とのことでした。
居酒屋抄読会in大都会、開催報告と臨床試験登録情報利用例
<はじめに>
ブログの更新をサボっておりました(・´ェ`・;)ゞ
8/26に開催しました、第一回居酒屋抄読会in大都会の開催報告になります。
<お題論文など>
PMID: 28390934
以下は臨床試験登録情報になります
今回は参加者が使い慣れているAHEADMAPのRCTを10分で読むためのワークシートを利用しました。
AHEADMAP会員募集チラシがダウンロード可能に! - aheadmap ページ!
録音は以下よりどうぞ
<批判的吟味>
①ランダム化?
→タイトルを見ると「Immunogenicity and safety of a quadrivalent inactivated influenza virus vaccine compared with a comparator quadrivalent inactivated influenza vaccine in a pediatric population: A phase 3, randomized noninferiority study」とあるのでランダム化されている
②PECOは?
P:AbstractのBackgroundの一番最後に「healthy children aged 5–17 years.」とあるので「5~17歳の健康な子供」でよさそう。本文からの追加情報もあまりない。
5~8歳と9~17歳で層別化されている
E:高純度4価インフルエンザワクチン(Seqirus)
C:FDAが承認している4価インフルエンザワクチン(GSK)
O1:赤血球凝集素(HI)抗体価の幾何平均差(非劣性マージン≤ 1.5)
O2:セロコンバージョン率の差(非劣性マージン≤ 10%)
③アウトカムは明確?
→2つなので明確
④真のアウトカム?
→代用
ワクチンで真のアウトカムとなると「発症率」「入院」「超過死亡」あたりだろうか。今回の試験は2015.9~2016.1と短期間での評価のため抗体価にしたのだろうか?
⑤盲検化
→Materials and methodsのStudy designの項に「This phase 3, randomized, observer-blinded, comparator-controlled, multicenter study evaluated IIV4 against an US-licensed 2015–2016 comparator IIV4 containing the same influenza strains recommended by the US Food and Drug Administration (FDA) and the Vaccines and Related Biological Products Advisory Committee for inclusion in the Northern Hemisphere 2015–2016 season. 」とある。一見するとPROBE法に見えるが、、、
ここで臨床試験登録情報、Descriptive InformationのStudy Designを見ると「Masking: Quadruple (Participant, Care Provider, Investigator, Outcomes Assessor)」とある。
つまりこの試験は4者へのブラインドをすることが計画されていたことがわかる。
※本試験は新ワクチンが旧ワクチンに比べ発熱が少ないことをウリにしているので盲検化は必須だと思われる。
⑥解析法
→FAS(プライマリアウトカムはper protocol)
⑦追跡率
→fig1より94.6%
⑧ベースライン
→気になる偏りは見つけられない
⑨結果
赤血球凝集素(HI)抗体価の幾何平均差(非劣性マージン≤ 1.5)
・A/H1N1 = A/California/7/2009 (H1N1) pdm09-like virus
新952.6 :旧958.8 GMT Ratio (95% CI) 1.01 (0.93, 1.09)
・A/H3N2 = A/Switzerland/9715293/2013 (H3N2)-like virus
新886.4 :旧930.6 GMT Ratio (95% CI) 1.05 (0.96, 1.15)
・B/YAM = B/Phuket/3073/2013-like virus
新 60.9 :旧54.3 GMT Ratio (95% CI) 0.89 (0.81, 0.98)
・B/VIC = B/Brisbane/60/2008-like virus
新145.0 :旧133.4 GMT Ratio (95% CI) 0.92 (0.83, 1.02)
セロコンバージョン率の差(非劣性マージン≤ 10%)
・A/H1N1 = A/California/7/2009 (H1N1) pdm09-like virus
新66.4 :旧63.3 SCR Difference (95% CI) −3.1 (−8.0, 1.8)
・A/H3N2 = A/Switzerland/9715293/2013 (H3N2)-like virus
新82.9 :旧83.3 SCR Difference (95% CI) 0.4 (−4.5, 5.3)
・B/YAM = B/Phuket/3073/2013-like virus
新58.5 :旧55.1 SCR Difference (95% CI) −3.4 (−8.3, 1.5)
・B/VIC = B/Brisbane/60/2008-like virus
新72.1 :旧70.1 SCR Difference (95% CI) −2.0 (−6.9, 2.9)
有効性ではすべての項目で非劣性を達成。
安全性で注目の「発熱」を見ると、Relative Risk (95% CI) 1.22 (0.62, 2.43)
<結論>
この結果なら既承認薬でええやん